| Главная » Статьи |
| Всего материалов в каталоге: 352 Показано материалов: 1-10 |
Страницы: 1 2 3 ... 35 36 » |
|
|
|
Здравствуйте, дорогие гости нашего сайта. В этой статье мы дадим Вам рекомендации по написанию итогового сочинения в 11 классе.
|
|
В атоме водорода только один электрон и его спектр испускания относительно прост. В спектрах испускания атомов других элементов число линий больше. Еще до появления модели Бора физики научились различать в таких спектрах близко расположенные линии, отличающиеся по внешнему виду. Одни из них (очень узкие) получили название "резких" (от англ. sharp). Наиболее яркие линии назвали "главными" (от англ. principle). Наблюдались более широкие линии - их назвали "размытыми" (diffuse). Еще один сорт линий имеет название "фундаментальных" (от англ. fundamental). По первым буквам английских названий говорили о наличии в спектрах испускания s-, p-, d- и f-линий. Применительно к модели Бора это означает, что в спектрах атомов более сложных, чем водород, постоянные электронные уровни могут состоять из нескольких близко расположенных подуровней |
|
В атоме водорода только один электрон и его спектр испускания относительно прост. В спектрах испускания атомов других элементов число линий больше. Еще до появления модели Бора физики научились различать в таких спектрах близко расположенные линии, отличающиеся по внешнему виду. Одни из них (очень узкие) получили название "резких" (от англ. sharp). Наиболее яркие линии назвали "главными" (от англ. principle). Наблюдались более широкие линии - их назвали "размытыми" (diffuse). Еще один сорт линий имеет название "фундаментальных" (от англ. fundamental). По первым буквам английских названий говорили о наличии в спектрах испускания s-, p-, d- и f-линий. Применительно к модели Бора это означает, что в спектрах атомов более сложных, чем водород, постоянные электронные уровни могут состоять из нескольких близко расположенных подуровней |
|
Одним из инструментов, который помог "заглянуть" внутрь невидимых, микроскопических атомов, послужила квантовая теория. В предыдущих разделах вы уже познакомились со многими понятиями, которыми эта теория оперирует (ядро, электронное облако, уровни, подуровни, орбитали, электронная конфигурация, минимум энергии и т.д.). Полезно еще раз вернуться к вопросу о том, как появились эти понятия, какие экспериментальные факты заставили исследователей нарисовать именно такую, а не иную картину строения атома. |
|
Наша задача - разобраться в том, как заполняются электронные уровни, подуровни и орбитали по мере усложнения атома. Существует условное изображение электронных уровней и подуровней, называемое орбитальной диаграммой. На такой диаграмме орбитали условно изображаются квадратиками, а электроны - стрелочками. Если стрелочки направлены в разные стороны, это означает, что электроны различаются между собой особым свойством, которое назывется спином электрона. В данный момент для нас не важна суть этого свойства. Требуется лишь понимать, что электроны могут чем-то отличаться друг от друга. |
|
В этом и в следующем параграфах рассказывается о моделях электронной оболочки атома. Важно понимать, что речь идет именно о моделях. Реальные атомы, конечно, более сложны и мы пока знаем о них далеко не все. Однако современная теоретическая модель электронного строения атома позволяет успешно объяснить и даже предсказать многие свойства химических элементов, поэтому широко используется в естественных науках. |
|
В природе элементы за редким исключением существуют в виде смесей из нескольких изотопов. Это ведет к тому, что атомный вес природного элемента несколько отличается от атомного веса любого из его чистых изотопов. Легче всего это понять из таблицы 2-2, где приведены атомные веса природных элементов и их изотопный состав. |
|
Атом состоит из ядра и окружающего его электронного "облака". Находящиеся в электронном облаке электроны несут отрицательный электрический заряд. Протоны, входящие в состав ядра, несут положительный заряд. В любом атоме число протонов в ядре в точности равно числу электронов в электронном облаке, поэтому атом в целом – нейтральная частица, не несущая заряда. Атом может потерять один или несколько электронов или наоборот – захватить чужие электроны. В этом случае атом приобретает положительный или отрицательный заряд и называется ионом. Практически вся масса атома сосредоточена в его ядре, так как масса электрона составляет всего лишь 1/1836 часть массы протона. Плотность вещества в ядре фантастически велика – порядка 1013 - 1014 г/см3. Спичечный коробок, наполненный веществом такой плотности, весил бы 2,5 миллиарда тонн! |
|
Атомы состоят из еще более мелких частиц, которые были открыты в разное время разными исследователями. Самой первой из таких частиц оказался электрон, несущий единичный электрический заряд. Электрон получил свое нынешнее название только в самом конце прошлого века, а до этого физики только предполагали, что существует некий "атом электричества", с помощью которого по проводам передается электрический ток. В 1853 году французский исследователь А. Массон решил попробовать пропускать электрические разряды (искры) через стеклянную трубку, из которой откачан воздух. Впоследствии с помощью этого несложного устройства англичанин Вильям Крукс провел множество опытов, и с тех пор такие трубки называют круксовыми (их прямые "потомки" - редко встречающиеся теперь электронно-лучевые телевизоры и мониторы). |
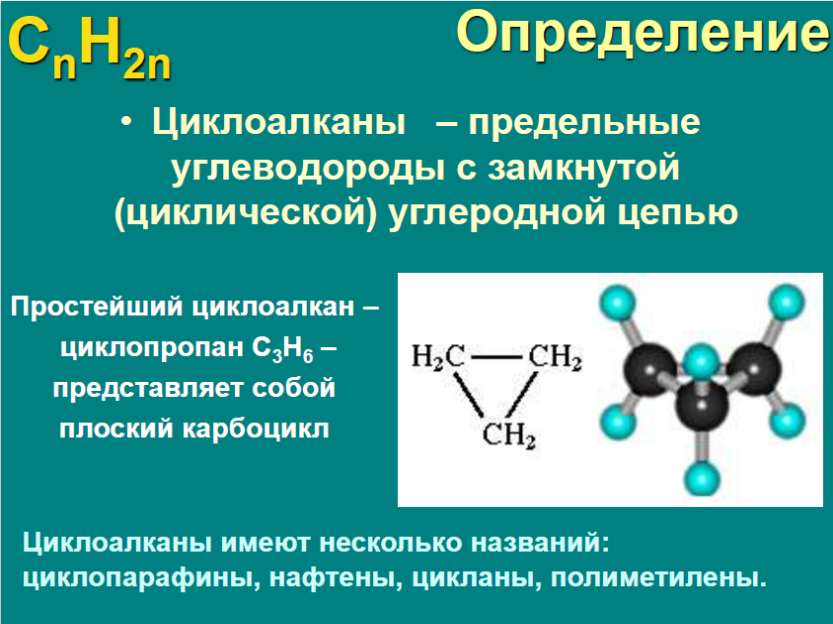 Это моя личная презентация по циклоалканам, она раскрывает самые основные аспекты в познаниях этой темы. Скачивайте и пользуйтесь на здоровье!
Это моя личная презентация по циклоалканам, она раскрывает самые основные аспекты в познаниях этой темы. Скачивайте и пользуйтесь на здоровье!