| Главная » Статьи » Химия » Атомы |
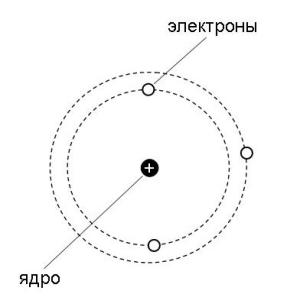
В этом и в следующем параграфах рассказывается о моделях электронной оболочки атома. Важно понимать, что речь идет именно о моделях. Реальные атомы, конечно, более сложны и мы пока знаем о них далеко не все. Однако современная теоретическая модель электронного строения атома позволяет успешно объяснить и даже предсказать многие свойства химических элементов, поэтому широко используется в естественных науках. Для начала рассмотрим более подробно "планетарную" модель, которую предложил Н. Бор (рис. 2-3 в).
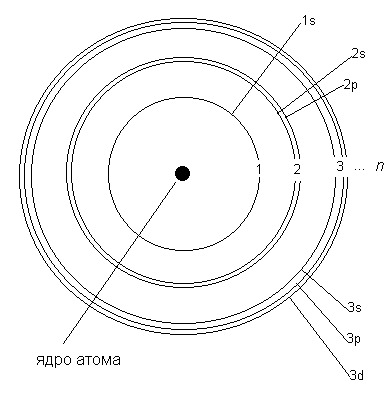
Рис. 2-3 в. "Планетарная" модель Бора. Как уже рассказывалось в этой главе, датский физик Н. Бор в 1913 году предложил модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца. Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель позволяет объяснить многие экспериментальные факты (подробнее об этом рассказывается в параграфе 2.7). Электронные орбиты в модели Бора обозначаются целыми числами 1, 2, 3, … n, начиная от ближайшей к ядру. В дальнейшем мы будем называть такие орбиты уровнями. Для описания электронного строения атома водорода достаточно одних только уровней. Но в более сложных атомах, как выяснилось, уровни состоят из близких по энергии подуровней. Например, 2-й уровень состоит из двух подуровней (2s и 2p). Третий уровень состоит из 3-х подуровней (3s, 3p и 3d), как показано на рис. 2-6. Четвертый уровень (он не поместился на рисунке) состоит из подуровней 4s, 4p, 4d, 4f. В параграфе 2.7 мы расскажем, откуда взялись именно такие названия подуровней и о физических опытах, которые позволили "увидеть" электронные уровни и подуровни в атомах.
Рис. 2-6. Модель Бора для атомов более сложных, чем атом водорода. Рисунок сделан не в масштабе - на самом деле подуровни одного уровня находятся гораздо ближе друг к другу. В электронной оболочке любого атома ровно столько электронов, сколько протонов в его ядре, поэтому атом в целом электронейтрален. Электроны в атоме заселяют ближайшие к ядру уровни и подуровни, потому что в этом случае их энергия меньше, чем если бы они заселяли более удаленные уровни. На каждом уровне и подуровне может помещаться только определенное количество электронов. Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей (на рис. 2-6 они не показаны). Образно говоря, если электронное облако атома сравнить с городом или улицей, где "живут" все электроны данного атома, то уровень можно сравнить с домом, подуровень - с квартирой, а орбиталь - с комнатой для электронов. Все орбитали какого-нибудь подуровня имеют одинаковую энергию. На s-подуровне всего одна "комната"-орбиталь. На p-подуровне 3 орбитали, на d-подуровне 5, а на f-подуровне - целых 7 орбиталей. В каждой "комнате"-орбитали могут "жить" один или два электрона. Запрещение электронам находиться более чем по двое на одной орбитали называютзапретом Паули - по имени ученого, который выяснил эту важную особенность строения атома. Каждый электрон в атоме имеет свой "адрес", который записывается набором четырех чисел, называемых "квантовыми". О квантовых числах будет подробно рассказано в параграфе 2.7. Здесь мы упомянем лишь о главном квантовом числе n (см. рис. 2-6), которое в "адресе" электрона указывает номер уровня, на котором этот электрон существует. В 20-е годы прошлого века на смену модели Бора пришла волновая модель электронной оболочки атома, которую предложил австрийский физик Э. Шредингер. К этому времени было экспериментально установлено, что электрон имеет свойства не только частицы, но и волны. Например, видимый нашими глазами свет представляет собой электромагнитные волны. Ряд свойств таких волн есть и у электрона. Шредингер применил к электрону-волне математические уравнения, описывающие движение волны в трехмерном пространстве. Однако с помощью этих уравнений рассчитывается не траектория движения электрона внутри атома, а вероятность найти электрон-волну в той или иной точке пространства вокруг ядра. Общее у волновой модели Шредингера и планетарной модели Бора в том, что электроны в атоме существуют на определенных уровнях, подуровнях и орбиталях. В остальном эти модели не похожи друг на друга. В волновой модели орбиталь - это пространство около ядра, в котором можно обнаружить заселивший ее электрон с вероятностью 95%. За пределами этого пространства вероятность встретить такой электрон меньше 5%. Полученные с помощью математического расчета такие "области вероятности" нахождения в электронном облаке s- и p-электронов показаны на рис. 2-7. 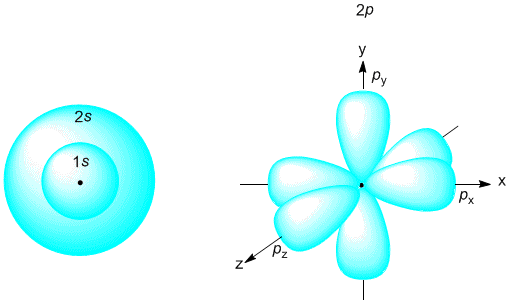 Рис. 2-7. Примерно такую форму в волновой модели атома имеют "области вероятности" существования электронов: s- и p-орбитали (d-орбитали имеют более сложную форму). ** Почему вообще пришлось вводить такое понятие, как вероятность нахождения электрона в той или иной точке пространства около ядра? Немецкий физик Гейзенберг в 1927 году сформулировал принцип неопределенности, являющийся одним из важнейших физических принципов для описания движения микрочастиц. Этот принцип вытекает из фундаментального отличия микрочастиц от обычных физических тел. В чем же это отличие? В классической механике предполагается, что человек может наблюдать явление, не нарушая его естественного хода. Например, можно наблюдать движение небесных тел в телескоп, и это никак не отразится на их движении. Астроном может произвести измерения и составить точное математическое описание движения объекта. Используя полученные формулы, можно предсказать, куда движется данный объект и где он будет находиться в любой момент времени. В микромире дело обстоит иначе. Например, исследуя движение электрона с помощью микроскопа (если бы такое было возможно), мы бы наблюдали отраженные от электрона волны света, энергия которых по величине сопоставима с энергией самих исследуемых частиц. Поэтому при выполнении измерений нами неизбежно вносились бы изменения в состояние электрона (местоположение, скорость, направление движения и т.д.). Значит, на основании наших измерений бессмысленно говорить о точном местоположении электрона в каждый момент времени. Принцип неопределенности говорит о том, что не следует пытаться вычислить точную траекторию электрона вокруг ядра. Можно лишь указать вероятность нахождения электрона в том или ином участке пространства около ядра в любой момент времени. Эта вероятность поддается вычислению с помощью математических методов. Итак, в волновой модели существуют орбитали разных видов: s-орбитали (сферической формы), p-орбитали (похожие на веретено или на объемные восьмерки), а также d- и f-орбитали еще более сложной формы. Они очерчивают область 95%-ной вероятности найти s-, p-, d- или f-электроны именно в том месте электронного облака, которое ограничено этими фигурами. Области вероятности нахождения s, p, d, f-электронов в атоме могут пересекаться - объяснение этому вы найдете в §2.7. Впрочем, к необычным свойствам волновой модели следует относиться спокойно, поскольку она является не столько физической, сколько абстрактной математической моделью электронной оболочки. Однако, как мы увидим в дальнейшем, такая модель обладает хорошей предсказательной силой в отношении химических свойств атомов и молекул. Во всех моделях атома электроны называют s-, p-, d- и f-электронами в зависимости от подуровня, на котором они находятся. Элементы, у которых внешние (то есть наиболее удаленные от ядра) электроны занимают только s-подуровень, принято называть s-элементами. Точно так же существуют p-элементы, d-элементы и f-элементы. **Чем выше (то есть чем дальше от ядра) находится электронный уровень, тем больше на нем может разместиться электронов за счет того, что число подуровней и орбиталей на удаленных уровнях постоянно увеличивается (это удалось выяснить экспериментально - см. параграф 2.7). Можно посчитать, что на n-м уровне помещается в сумме n2 различных орбиталей, а электронов - вдвое больше: 2n2, потому что любая орбиталь способна вмещать не более двух электронов. Таблица 2-4. Наибольшее возможное число электронов на первых 4-х электронных уровнях.
Эти сведения нам нужны для того, чтобы научиться “расселять” электроны по уровням в атоме любого элемента. А химические свойства элемента, как мы увидим чуть позже, определяются электронами самого последнего (наиболее удаленного от ядра) заселенного уровня. | |||||||||||
| Просмотров: 956 | | | |||||||||||
| Всего комментариев: 0 | |